【会议】11月5日- 6日2022统计学工具在研发注册、分析方法开发、项目管理及分析评价中的应用专题培训班
为了能帮助企业进行风险识别、提升公司质量管理水平并发现潜在风险,我们特邀请制药资深质量人同时也是数据统计专家,于 2022年11月5日- 6日在线上举办“2022统计学工具在研发注册、分析方法开发、项目管理及分析评价中的应用专题培训班”,从法规指南要求、研发管理流程、数据统计分析、限度制定、报告编写以及常见问题等系统深度剖析,结合丰富案例和数据统计分析现场演练,全面提升企业年度质量回顾的理论认知和问题解决实操能力。
会议安排
线上地址:腾讯会议(开课前一周发送线上链接,可一个月内无限次回看)
会议时间:2022年11月5日- 6日(上午9点-12点,下午1点30-4点30)
会议内容
|
第一天 09:00-12:00 13:30-16:30 |
一、统计分析应用基本原则 1. 数据类别与药品研发注册管理协调管理 l 数据分类属性 l 数据属性与产品工艺特征性评价 l 基本统计学定义和常用统计分析方法概述 2. 统计学应用在研发注册管理中需要了解的事项 l 标准品与对照品管理原则 l 色谱试剂管理要点 l 工艺研发关联原辅料供应商管理原则 3. 产品注册与备案管理有关统计学要求 l 产品描述与生产工艺 l 处方筛选相关数据要求 l 配套研发涉及的公用系统、厂房设施、实验室监测数据要求 l 工艺研发配套制药用水管理 l 研发期间洁净厂房与洁净室管理要求 l 检验区域样品管理一般要求 l 其他配套硬件设施与厂房变更、维护管理与客观记录 4. 数据汇总与数据管理规范在ICH指南中基本原则条款解释 5. 常用数据评估软件选择与特点 二、工艺选择与评价(主效应模式的管理原则) 1. t分析评估方式在工艺研发阶段使用原则(涵盖检验方法学研究和检验方法变更) 2. t分析与方差分析(含方差齐性评价管理原则) 3. 方差分析与主效应模式在工艺研发中应用( 案例 类) 4. 工艺规程表述规范与统计学原则协调一致性管理 5. 处方筛选中的“关键质量属性的评价与再评估” 6. 关键质量属性与关键工艺参数相关性评价 |
|
第二天 09:00-12:00 13:30-16:30 |
三、研发项目中统计学应用管理(变更管理、处方参数优选) 1. 小试研发阶段统计学一般要求(DOE方案选择原理) 2. 工艺验证管理(DOE设计中 仿行 区块 选择依据和评价原则) 3. 工艺中试放大中统计分析关联数据管理原则 l 元数据与元信息 l 环境与中试硬件参数的管理 l 不同原辅料供应商与操作人员影响度评价管理 l 产品工艺放大管理与持续工艺确认管理 4. 研发工艺转移管理要求 5. 持续工艺确认(研发项目界段和工艺转移后管理) 四、检验方法学研究、产品稳定性研究与留样观察 1. 产品稳定性研究管理原则(含检验方法学开发研究统计学一般要求) 2. 检验方法学中“置信度、置信区间、精密度、准确度”管理 3. 留样观察与产品留样管理原则 4. 市售产品观察数据汇总与评价 5. 产品有效期预测与计算管理与评价 6. 超趋势管理原则与实施(OOT) 7. 稳定性研究中的“警戒限度与行动限度”管理 五、研发项目中的“不合格品管理与销毁” 1. 不合格品定义与分区管理 2. 不合格品销毁与转变使用 3. 不合格与超标事件(OOS)管理与区分 六、研发管理中的药政事务管理与外部审核 1. 内审管理与纠正措施 2. 外部审核与不符合项整改 3. 药品注册与备案、告知 4. 委托检验、共用实验室、实验室方法转移管理 |
主讲老师:李老师 行业知名统计学专家,开展企业内训数十次。国家局及省局检查员培训讲师。就职于国内知名龙头企业高级审计,六西格玛黑带大师;从业二十余年,对工艺研发与产品注册、药品生产管理、质量体系建设项目等有丰富的实战经验,多次经历WHO、TGA国内现场检查,协会特聘专家。
培训费:4000元/链接(会务费包括:培训、答疑、证书、发票、电子版资料、视频回看等)

-
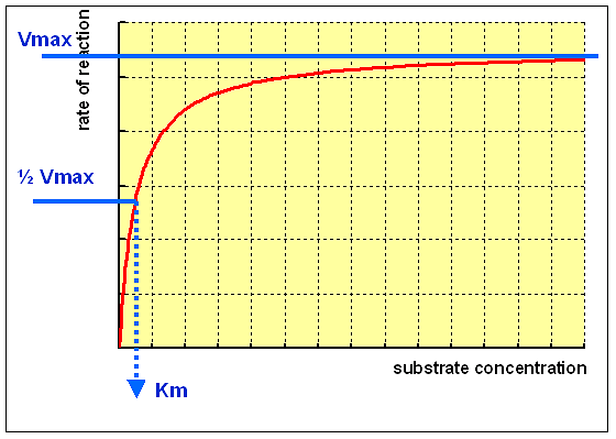
碳氮比的概念和优化方法
碳氮比(C/ N) :严格意义上应是指在微生物培养基中所含的碳源中的碳原子摩尔数与氮源中的氮原子摩尔数之比。(周德庆微生物学教程),在这里,我认为对于既能做碳源又能做氮源的物质应该及计算碳源又计算氮源。很多情况我们简单用培养基的碳源和氮源的比值来替代,但这是不准确的。另外由于一些培养基成分中的碳源不易利用,碳氮比也有用还原性碳源和粗蛋白之间的比值来替代,比如下式碳氮比的计算,就是用葡萄糖中的碳元素的摩尔浓度比上总蛋白中氮元素的摩尔质量浓度。
넶3443 2021-09-09 -
【发酵基础】P1,P2,P3,千级、万级和十万级,关于微生物实验室的安全和洁净
넶2104 2020-05-08 -
-
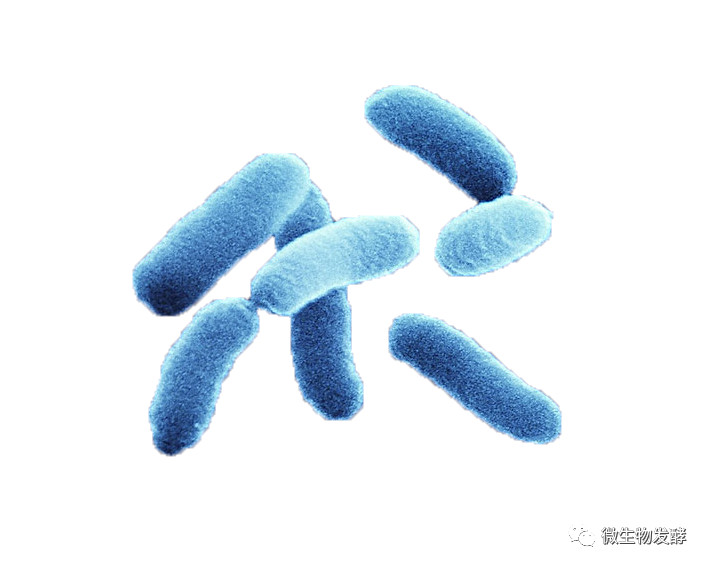
【发酵基础】常用灭菌、消毒、除菌和防腐方法及其特征
染菌与控制是发酵圈永远绕不开的话题。降低染菌率是每一个发酵人应该认真学习和考虑的问题。而合理的应用灭菌、消毒和防腐方法是我们必备的技能。这也是我们在详细介绍发酵过程染菌防控之前需要介绍的内容之一。
넶744 2020-04-29 -
-